- · 《治理研究》刊物宗旨[08/03]
- · 《治理研究》征稿要求[08/03]
- · 《治理研究》投稿方式[08/03]
- · 《治理研究》数据库收录[08/03]
- · 《治理研究》栏目设置[08/03]
国内首次!《急性心肌梗死后心室重构防治专家共
作者:网站采编关键词:
摘要:【心梗后心衰是心血管疾病领域的重要研究内容,然而既往国内并没有相关的指南或者共识。因此相当一段时间内,临床诊疗多以经验为主。此共识的发表既为临床诊疗提供工具,也为
【心梗后心衰是心血管疾病领域的重要研究内容,然而既往国内并没有相关的指南或者共识。因此相当一段时间内,临床诊疗多以经验为主。此共识的发表既为临床诊疗提供工具,也为科研工作者指明了方向和重点。】
近日,国内首个“急性心肌梗死后心室重构防治专家共识”在《中华心血管病杂志》(网络版)发布。(此共识由中国医师协会胸痛专业委员会、中华心血管病杂志(网络版)编辑委员会、急性心肌梗死后心室重构防治专家共识起草组发布。)
特编辑原文格式,供业内同行参考学习。
《急性心肌梗死后心室重构防治专家共识》
急性心肌梗死(acute myocardial infarction,AMI)后心室重构与心力衰竭(heart failure,HF)发生以及疾病预后密切相关[1],《中国心力衰竭诊断和治疗指南2018》、 2016年欧洲心脏病学会(European Society of Cardiology,ESC)急、慢性心力衰竭诊断和治疗指南和2013年美国心脏病学会(American College of Cardiology,ACC)/美国心脏协会(American Heart Association,AHA)等指南的部分章节均提出了AMI后心室重构的治疗建议[2-4],但目前尚无针对该领域的指南或共识。基于此,由中国医师学会胸痛专业委员会、中华心血管病杂志(网络版)编辑委员会以及急性心肌梗死后心室重构防治专家共识起草组共同制定本共识,内容涉及AMI后心室重构的定义、流行病学与发病机制、评估指标与诊断工具、诊断与治疗及随访管理等,旨在规范AMI后心室重构的早期防治,提高我国AMI后心室重构临床诊治水平。
▼ 一、定义
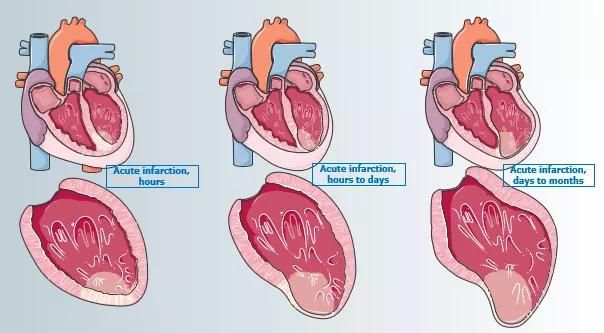
AMI后心室重构,是指AMI后心室持续发生的大小、形态、结构和功能的改变过程,可表现为左心室扩大、左心室射血分数(left ventricular ejection fraction, LVEF)降低和/或局部室壁活动异常,是决定AMI后心脏事件发生率和远期预后的主要因素[5]。在患者出现HF症状前,心室重构多表现为无症状的结构和功能异常(心脏的收缩或舒张功能不全)。
AMI后心室重构可分为早期重构和晚期重构:(1)早期心室重构常在AMI后24~72h内发生,主要表现为梗死面积扩大和心室腔扩张,心肌细胞坏死及心肌顿抑;(2)晚期心室重构主要表现为心肌细胞肥大、凋亡和弥漫性纤维化,通常在数周内(偶尔在数月内)发生,晚期心室重构个体化差异大,可以延续数月甚至1年。早期心室重构与晚期心室重构间主要差异见表1[6]。

▼ 二、流行病学与发病机制
2.1 流行病学
AMI后患者中出现无症状左心室收缩功能障碍(left ventricular systolic dysfunction,LVSD)的比率高达30%~60%[7]。心肌梗死患者即使已行经皮冠状动脉介入治疗(percutanous coronary intervention,PCI),心肌梗死后HF发生率仍然倍增[8]。一项连续入选284例接受经皮腔内冠状动脉成形术治疗的AMI患者的研究,在观察了24h、1个月、6个月的心电图(electrocardiograph, ECG)和心脏造影后,30%的AMI患者在PCI后6个月发生了心室重构[心室重构定义:6个月时左心室舒张末期容积(left ventricular end-diastolic volume, LVEDV较基线≥20%][9]。因此,AMI后心室重构是HF发生的独立预测因素,同时是影响患者预后的主要因素之一[1]。
2.2 发病机制
AMI后心室重构受性别、年龄、吸烟、肥胖、糖尿病、高血压、血脂异常、心肌梗死部位、是否为多支血管病变、是否为慢性完全闭塞性病变(chronic total occlusion,CTO)及是否合并瓣膜病变等多种危险因素的影响[10-15]。其中,前壁心肌梗死发生心室重构的风险较其他部位增加了1.9倍[12],多支病变患者心室重构的风险较单支病变患者高1.2倍[13],CTO病变和瓣膜病的严重程度与心脏重构的程度密切相关[14-15]。
AMI后心室重构的发生涉及心肌梗死、肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)、交感神经系统与利钠肽(natriuretic peptide,NP)系统等神经内分泌系统的激活以及炎症免疫反应等病理机制。RAAS对不良心室重构的影响主要源于血管紧张素Ⅱ表达的增加。在大鼠模型中,持续输注血管紧张素Ⅱ可导致血管周围和间质胶原含量增加[16]。近年来,NP系统的激活在AMI后心室重构中的重要作用颇受关注,如NP能控制血压和血容量。研究发现B型利钠肽(B-type natriuretic peptide, BNP)能发挥强大的抗心肌肥大与抗心肌纤维化效应[17],BNP升高可拮抗被激活的交感及RAAS系统的活性,AMI后心功能越差,BNP水平越高[10]。
文章来源:《治理研究》 网址: http://www.zlyjzz.cn/zonghexinwen/2020/0926/639.html